
|
本拠点の概要>拠点メンバー一覧>拠点メンバーの紹介・小糸 厚
|

大学院生命科学研究部・特任教授 ウイルス学・医学博士
国際研究員会 HIV感染機構の解析

 |
 マウス、ラット, ウサギなどは、ヒト病原性ウイルス感染症の病態・防御免疫機構を個体レベルで解析しうる小動物モデルになる可能性をもつ。 エイズの病因ウイルスであるヒト免疫不全ウイルス(HIV)の宿主域は極めて狭く、HIV感受性を持ったトランスジェニックモデルの開発が試みられたが、ヒト型のCD4,コレセプターを導入しても、これらの実験用動物で十分なHIVの複製は得られず、それを規定している宿主因子群がすべて明らかになっているわけではない(1)。われわれは、げっ歯類の細胞ではHIV Gagの細胞質膜への移行が著しく非効率であり、この過程への未知の宿主因子の関与を示した(2)。また小動物の中でも、ミンクの細胞はげっ歯類のものと異なりHIV複製をヒトと同等にサポートすることを見出した(3)。 |
|
一方で、ヒトに続いてマウス、ラットなどのゲノム塩基配列が解読されたが、その意味については、多くが理解の途上にある。マウス,ラットにはHIV複製に必須な因子が欠如しているのみならず、レトロウイルスの複製を阻害する活性があることが、近年明らかになりつつある。これらの哺乳類ゲノム中には共通して内在性レトロウイルス、レトロエレメントなどの反復配列が多く蓄積しており、実にゲノム全体の4割を占める。生物のゲノムには、その進化の歴史が刻み込まれているが、HIVなどレトロウイルスの祖先である種々のレトロエレメントが、宿主の自然免疫系と何千万年もの間、共存しながら宿主ゲノムの拡大、多様性獲得に関与してきたことが示唆されている。 これらのレトロポジションの制御にもかかわるシチジン脱アミノ化酵素APOBEC3がHIVなど外来性レトロウイルス感染を制御する優性インヒビターとして機能することが明らかになった。HIVはVifというアクセサリー遺伝子でAPOBEC3に拮抗するが、ATLの病因ウイルスであるHTLV-1などのoncovirusはこの抗ウイルス活性に抵抗性であり、そのメカニズムは不明である(4)。APOBECファミリーに属するAPOBEC1は、ヒトでは小腸でのみ発現がみられ,コレステロール代謝に重要なアポリポタンパク質B mRNAのエディティングをおこなう。われわれは、げっ歯類やウサギ由来のAPOBEC1がHIVのみならず様々なレンチウイルス感染を強く抑制し、プロウイルス中のG/A変異と同様に、C/T変異を多く導入し、ゲノムRNAをターゲットとすることを明らかにした(5)。 これらの小動物ではAPOBEC1分子は小腸のみならず脾臓など様々な組織で発現しており、自然防御機構として機能している可能性が示唆された。その標的は内在性レトロエレメントなどへ、さらに広がりをみせるものと予想される。レトロウイルスの種間の伝搬を阻止するバリアーであると同時に宿主ゲノムの安定性に寄与するAPOBECファミリーの機能解明は、自然免疫機構の普遍的な理解に大きく貢献する。さらに、これらの成果は、小動物モデル開発への展望をひらくとともに、新たな治療の標的策定につながると期待される。 |
|
|
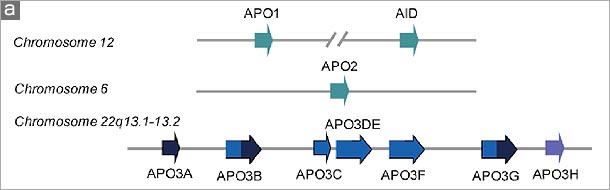
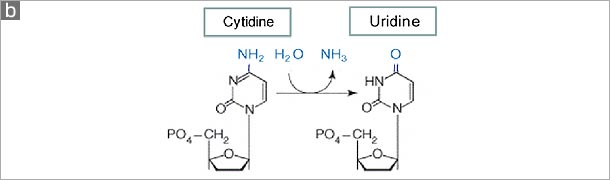
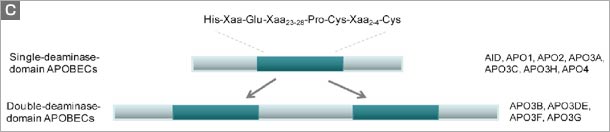
図 抗HIV宿主因子APOBECファミリー。(a) ヒトに存在するAPOBECファミリー遺伝子の染色体上での位置を示す。APOBEC1と相同遺伝子であるAID (activation-induced cytidine deaminase)はヒト12番染色体上の約1Mb離れた場所に存在する。6番染色体にはAPOBEC2が、22番染色体には3A~3Hの7つのAPOBEC3遺伝子が150kbの間に存在するが、この遺伝子増幅はヒトなど霊長類に特徴的でありマウス、ラットなどげっ歯類ではみられない。霊長類祖先のゲノム内でなんらかの選択圧によりAPOBEC3遺伝子の増幅がおこったと考えられる。 (b) シトシンの加水分解による脱アミノ化反応により天然にはないウラシルが生じるが、APOBECファミリーはこのDNAあるいはRNAの修飾反応を触媒する。 (c) APOBECファミリー分子の酵素活性中心部にはHis-X-Glu-X23-28-Pro-Cys-X2-4-Cys (X は任意のアミノ酸)配列が存在し、脱アミノ化反応においてヒスチジン(His)残基と2ヶのシステイン(Cys) 残基は亜鉛イオン(Zn2+)の配位に、グルタミン酸(Glu)はプロトンシャトルに関与する。APOBECファミリー分子には、この酵素活性中心部のモチーフが1ヶあるいは2ヶ存在し、それぞれDNAミューテーターあるいはRNAエディターとして多様な機能を生体内において発揮する。 |

参考文献
| 1. | Sawada, Gowrishankar, Kitamura, Suzuki, Suzuki, Tahara & Koito.: J. Exp. Med. 187: 1439, 1998. |
| 2. | Koito, Shigekane & Matsushita.: Virology 305:181, 2003. |
| 3. | Koito, Kameyama, Cheng-Mayer & Matsushita.: J. Virol. 77: 5109, 2003. |
| 4. | Ohsugi & Koito.: J. Virol. Method 139: 93, 2007. |
| 5. | Ikeda,
Ohsugi, Kimura, Matsushita, Maeda, Harada & Koito.:
Nucleic Acids Res. 36: 6859, 2008. |
 |
 |