|
| 私の研究発表ですが、新規のHIV-1プロテアーゼ阻害剤であるGRL-98065に関して発表しました。 |
|
|
この化合物はMTT assayおよびp24 assayにおいて、野生型HIV-1およびHIV-2株、複数の臨床分離多剤耐性株、試験管内で誘導された複数の既存プロテアーゼ阻害剤高度耐性変異株に対し非常に強力な抗ウイルス活性を示しました。また細胞に対する毒性は軽度という特性を有します。
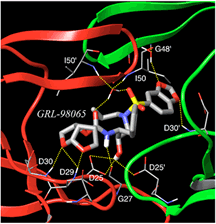
結晶構造解析ではP2部位にbis-THFというユニークな構造を有し、HIVプロテアーゼ活性部位であるAsp29/Asp30の主鎖(back bone)と極めて強固な水素結合を形成します。更に対側P2’部位のbenzodioxole構造がHIVプロテアーゼのflap領域と水素結合を持ち、これにより薬剤とプロテアーゼとの結合が安定化すると推測されます。
これらの作用によって多剤耐性変異株を含めた広いスペクトラムでの強い抗HIV活性を発揮すると考えられ、薬剤耐性HIV感染症例の有望な治療薬となる可能性が示唆されます。
多数の研究者と本研究に関する議論を交えることが出来、非常に有意義でした。
|
|
|
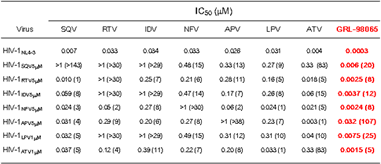
| MT4細胞を標的細胞としたp24 assayにおいて、既存のプロテアーゼ阻害剤(SQV, RTV, IDV,
NFV, ATV, LPV)に高度耐性を獲得した試験管内耐性誘導変異株に対してGRL-98065は強い活性を維持していました (IC50: 1.5〜7.5
nM)。類似構造を有するAPV高度耐性HIV-1変異株に対しては、野生型と比べ107倍の活性低下を認めました (IC50: 32 nM)。(括弧内の数字は野生型HIV-1NL4-3と比較して何倍活性が低下したか
(fold change) を示します ) |
|
|
|
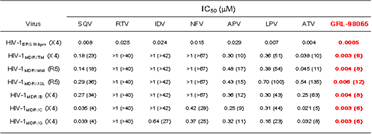
| PHA-PBMCを用いたp24 assayにおいて、GRL-98065は複数の多剤耐性臨床分離株(MDR)に対して強力な抗HIV-1活性を示しました
(IC50: 2〜6 nM)。 |
|
|
|
| 結晶構造解析によって、GRL-98065はHIVプロテアーゼの主要な活性部位であるAsp-29とAsp-30の主鎖と極めて強固な水素結合を形成していること、更にP2’部位のbenzodioxole構造がHIV
プロテアーゼのflap領域のGly-48と水素結合を有することで、プロテアーゼと薬剤との結合を安定化させることが明らかになりました。 |
|
| 海外発表支援トップへ戻る |
|
| |
|