本プロジェクトでは既存のPIと異なった活性グループを有し、多剤耐性HIV-1変異株に対して強力な活性を発揮、また耐性変異株の出現を許さない(または遅延させる)新世代のPIを創生するものである。我々は既にbis-tetrahydrofuranyl-urethane(bis-THF)を「核」として有するPI, UIC94017/TMC114臨床試験(Phase IIb)に進めているが、このTMC114は既存のPIが主としてプロテアーゼの活性部位の側鎖に結合するのと異なり、主要活性部位であるAsp-29/Asp-30の主鎖 (backbone)と極めて強固な水素結合を形成して、多剤耐性株を含む広いスペクトラムのHIVに活性を発揮する。本プロジェクトではbis-THFとは異なる複数の「核」をデザイン、合成し、有望な誘導体を同定、薬理動態などについても優れたものとするoptimizationを続けて、臨床応用可能な新世代のプロテアーゼ阻害剤を創生する。
HIV-1の細胞への侵入の初期過程は、HIV-1の外套(envelope)糖蛋白であるgp120が最初のレセプターである細胞膜表面CD4分子に結合することで始まるが、続いてgp120が構造変化すると、gp120-CD4複合体が二つ目のレセプター (コレセプター)であるケモカインレセプター(CCR5またはCXCR4)と結合、結果的にウイルスが宿主細胞膜に融合、ウイルスの内容物が細胞内に注入されて、感染が成立して行く。この侵入の何れかの過程を阻害する事でウイルスの増殖を阻止しようとするのが侵入阻害剤である。
1996年、白人の約1%にCCR5遺伝子の32個の塩基を欠損 (D32)、CCR5を発現していないが健常と思われる個体が存在し、そのような個体がHIV-1感染に抵抗し、感染しても AIDSを発症しにくいことが報告されて、CCR5が免疫・防御機能の発動・維持不可欠の分子ではない可能性が提起されて、多くのグループが一斉に研究・開発に乗り出した。
我々が研究を進めている一群のCCR5に対するアンタゴニスト (spirodiketopiperazine誘導体) はR5 HIV-1の増殖を強力に抑制するが (Maeda & Mitsuya, JBC, 276:35194-200, 2001)、その一員であるAK602/ONO4128/GW873140 (aplaviroc; AVC) (図2) は試験管内で強力な活性を示し (IC50:0.2nM)、既存の抗HIV剤と交差耐性を示さず(Maeda & Mitsuya, J.Virol, 78: 8654-62,2004)、作用機序の異なる他の薬剤との併用においても相乗効果を示した。また、高ウイルス血症を引き起こす動物モデル (huPBL-NOD-SCID マウス) の系でも強力な抗HIV活性を示した (図3) (Nakata & Mitsuya, J.Virol, 79: 2087-96,2005)。AVCはphase 2a臨床試験のいずれにおいてもAK602は重篤な副作用を認めず、HIV感染者への10日間の投与で平均1.6 logのHIV-RNA量の減少をもたらしている (図2)。 AVCは非常に強いCCR5への結合親和性(KD値: ~3 nM)を有するが、CCケモカイン(RANTES)のCCR5への結合にはわずかしか影響を与えない8)。この事はAVCの長期投与に基づく本来の防御応答能への悪影響が少ない可能性を示すと思われる。我々は現在AVCの種々の特性を構造学的に解析、他のCCR5阻害剤についても検討を加えており、今後更に抗HIV作用に特化したCCR5阻害薬の開発が可能と考えられる。
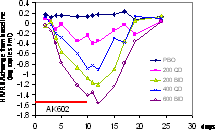
図2. 10日間のAK602投与により、600mg B.I.Dの群で平均1.6 logの血中HIV-RNAコピー数の減少が見られたのをはじめ、いずれの群においてもHIV-RNAの低下が認められた。副作用は軟便など軽微なもので、2-3日で症状は消失した。